膠質母細胞瘤(GBM)是星形細胞腫瘤中惡性程度最高(gāo)的(de)膠質瘤,也是最常見的(de)、極具侵襲性的(de)原發性惡性腦腫瘤。這類腫瘤具有惡性程度極高(gāo),早期浸潤的(de)性質,無法完全通過手術切除,對化療和(hé)放療的(de)內(nèi)在耐藥性也導緻了較差的(de)臨床結果,絕大部分的(de)患者預後極差:經标準的(de)手術放化療等治療手段後,其生存中位數隻在15個月左右,五年(nián)生存率低(dī)于5%,作為(wèi)當今腫瘤治療中的(de)重大挑戰之一(yī),急需開發新的(de)方法以改善患者的(de)預後,提高(gāo)其生存質量。
近年(nián)來,随着對免疫調節機制的(de)深入研究,免疫檢查點抑制劑的(de)應用使腫瘤治療從傳統的(de)放療、化療向精準靶向治療發展,在黑色素瘤、肺癌等腫瘤的(de)治療中展現出顯著成效。CD47與SIRPα協同作用,是腫瘤細胞逃脫巨噬細胞吞噬的(de)重要免疫檢查點。抗CD47抗體通常在人IgG4支架上進行工程設計,以最大限度地(dì)減少先天免疫的(de)Fc依賴性效應功能。IgG1形式的(de)抗CD47抗體具有更強的(de)抗GBM活性。然而,直接使用IgG1形式的(de)抗CD47抗體對GBM進行全身治療,仍存在輸注毒性和(hé)難以穿透血腦屏障等問題,
溶瘤病毒療法是新興的(de)一(yī)種免疫療法,使用具有複制能力的(de)病毒選擇性地(dì)複制和(hé)殺死癌細胞。溶瘤病毒(OVs)通過不同的(de)機制導緻癌細胞死亡,包括凋亡、焦脫和(hé)壞死。直接溶瘤釋放廣泛的(de)腫瘤相關抗原(TAAs)/新抗原或危險相關分子(zǐ)模式和(hé)病毒病原體相關分子(zǐ)模式,在腫瘤微環境中觸發炎症免疫反應 (TME)。 溶瘤單純疱疹病毒-1(oHSV)是研究最廣泛的(de)溶瘤病毒之一(yī),它可(kě)以選擇性溶解癌細胞,同時使正常細胞基本保持完整。與許多其他溶瘤病毒一(yī)樣,oHSV也能激活患者的(de)免疫系統攻擊腫瘤細胞。因此,以工程化 oHSV 表達可(kě)以增強免疫反應和(hé)/或阻斷免疫檢查點參與的(de)轉基因可(kě)能是提高(gāo) oHSV 對 GBM 的(de)整體功效的(de)有效方法。
2021年(nián)10月,美國希望之城國家醫療中心 Yu Jianhua 團隊等在 Nature Communications 期刊上發表:“An oncolytic virus expressing a full-length antibody enhances antitumor innate immune response to glioblastoma”的(de)研究論文。

該團隊将溶瘤病毒療法和(hé)抗體療法相結合,以溶瘤單純疱疹病毒作為(wèi)治療和(hé)抗體遞送的(de)平台,通過構建工程化溶瘤病毒,直接破壞腫瘤細胞,并将“冷腫瘤”轉化為(wèi)“熱腫瘤”,調控腫瘤微環境間接破壞腫瘤細胞。
工程化的(de)溶瘤單純疱疹病毒誘導巨噬細胞的(de)Fc受體介導的(de)腫瘤吞噬和(hé)NK細胞的(de)腫瘤細胞毒性,顯著延長(cháng)膠質母細胞瘤小鼠模型的(de)存活時間。因此,工程化溶瘤單純疱疹病毒是強化膠質母細胞瘤溶瘤病毒治療的(de)一(yī)種有希望且毒副作用極小的(de)方法。
研究團隊首先評估了六種人類GBM細胞系細胞表面表達CD47的(de)水平,發現六種細胞系均在表面均勻表達CD47。然後,團隊構建兩種工程化溶瘤單純疱疹病毒:以IgG1為(wèi)支架的(de)OV-αCD47-G1和(hé)以IgG4為(wèi)支架的(de)OV-αCD47-G4。
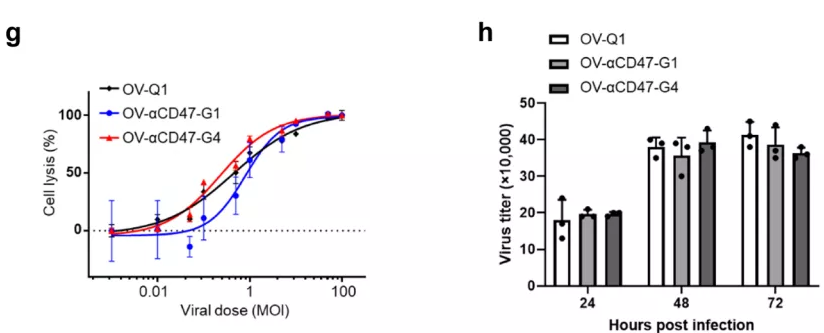
然後團隊用兩種病毒感染GBM細胞,結果發現在感染後的(de)一(yī)段時間GBM細胞可(kě)持續釋放出相當數量的(de)CD47抗體(圖1 g),同時,這兩種工程化oHSV還發揮出強大且相似的(de)溶瘤能力和(hé)複制病毒的(de)能力(圖1 h)。
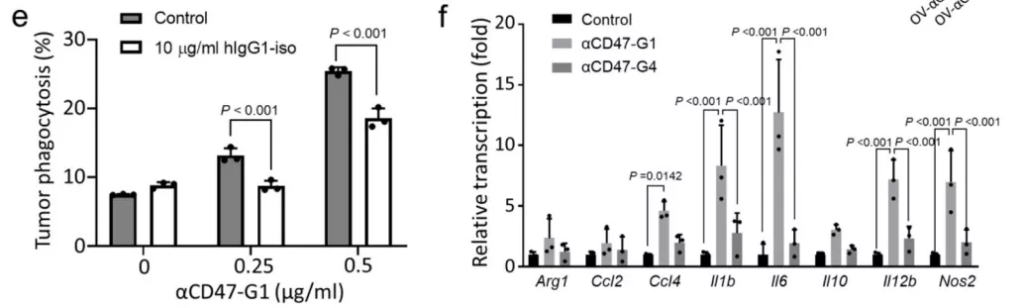
接下來,研究團隊比較兩種溶瘤病毒通過調節小鼠和(hé)人免疫細胞,殺死人類GBM細胞的(de)能力。被溶瘤病毒感染的(de)GBM細胞釋放的(de)αCD47-G1顯著誘導了骨髓源性巨噬細胞(BMDM)去(qù)吞噬患者來源的(de)GBM43細胞,而單純對Fc受體進行阻斷顯著抑制了其誘導BMDM的(de)吞噬作用(圖2 e),這表明感染後的(de)GBM細胞分泌αCD47-G1,阻斷腫瘤細胞發出“不要吃我”信号,增強了巨噬細胞的(de)吞噬作用 。此外,與αCD47-G4相較,αCD47-G1 更能誘導NK 細胞對 GBM 細胞的(de)抗體依賴性細胞毒作用(ADCC)(圖2 f)。
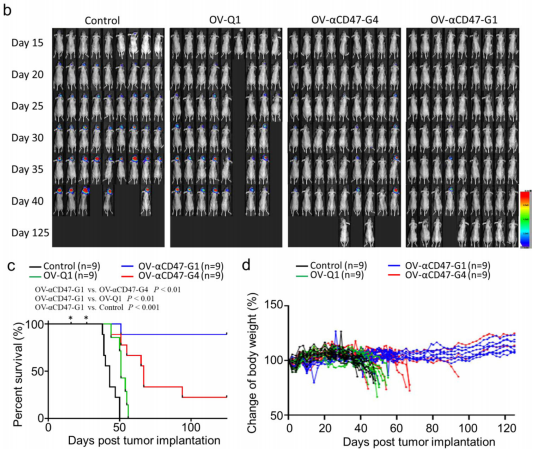
之後,研究團隊通過構建無胸腺裸鼠構建GBM 小鼠模型,對OV-αCD47-G1與OV-αCD47-G4在人GBM原位模型中提高(gāo)GBM體內(nèi)溶瘤病毒治療效果進行比較,結果表明OV-αCD47G1 在體內(nèi)抑制 GBM 腫瘤進展方面明顯比 OV-αCD47G4 更有效,并且兩者都優于對照病毒 OV-Q1(圖3)。
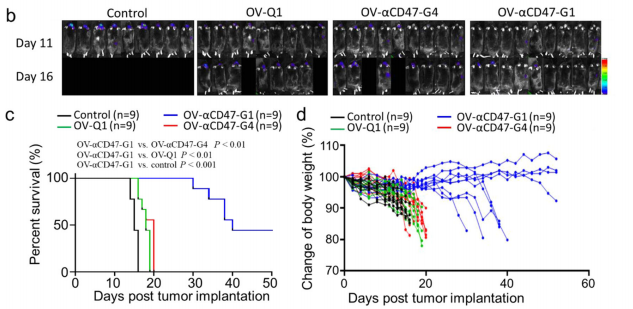
最後,研究團隊評估了OV-αCD47-G1在免疫活性GBM小鼠模型中的(de)療效。他們使用了易受oHSV感染的(de)改良CT2A小鼠GBM模型:将小鼠CT2A-GBM細胞修飾為(wèi)表達人CD47的(de)CT2A細胞。其目的(de)是為(wèi)了αCD47-G1抗體能與CT2A-hCD47 GBM細胞上表達的(de)人CD47結合。通過将CT2A-hCD47細胞注射到具有免疫活性的(de)野生型C57BL/6小鼠體內(nèi),他們建立了GBM免疫活性小鼠模型。與OV-αCD47-G4相比,OV-αCD47-G1組小鼠的(de)中位生存期顯著延長(cháng),表明表達以溶瘤病毒為(wèi)平台表達全長(cháng)IgG1CD47抗體是一(yī)種創新、方便,并能治療實驗性GBM的(de)有效方法(圖4)。
綜上所述,該研究團隊開發了一(yī)種有效的(de)溶瘤單純疱疹病毒工程化平台,通過感染直接誘導腫瘤溶解,并通過天然免疫浸潤和(hé)激活、巨噬細胞的(de)免疫檢查點抑制和(hé)Fc依賴性天然免疫細胞細胞毒性功能,向局部區域輸送全長(cháng)單克隆抗體,用于治療GBM。同時該平台可(kě)以嘗試到表達其他靶向抗體,作用于腫瘤微環境中的(de)免疫或腫瘤細胞,将溶瘤病毒療法和(hé)單克隆抗體療法結合,提高(gāo)治療腫瘤的(de)療效。
文章(zhāng)來源:https://doi.org/10.1038/s41467-021-26003-6
