根據以往研究發現溶瘤病毒(OVs)能夠對腫瘤微環境(TME)有一(yī)定的(de)激活作用,并引起浸潤性腫瘤特異性T細胞的(de)免疫反應。然而,OVs治療對腫瘤中的(de)腫瘤免疫檢查點起了負面影響,減弱了抗腫瘤免疫反應。因此,開發新的(de)策略來最大限度地(dì)發揮OVs的(de)潛力迫在眉睫。溶瘤病毒 (OVs) 在癌症治療中有出色的(de)臨床療效,然而,僅有幾種癌症類型得到改善[1]。
首先,OVs 的(de)內(nèi)部傳播受到腫瘤異質性和(hé)宿主抗病毒免疫反應的(de)限制,而病毒在腫瘤內(nèi)的(de)有效複制和(hé)傳播需要更強大的(de) OVs。其次,腫瘤微環境 (TME) 通常包含免疫抑制因子(zǐ),要逆轉這種負面的(de)癌症免疫設定點,需要更合适的(de)免疫調節劑的(de)組合來進行治療[2]。PD-1是淋巴細胞上的(de)一(yī)種抑制受體,腫瘤通過抑制性配體程序性死亡配體1(PD-L1)逃避T細胞反應[3]。
作者前期研究表明,癌細胞上的(de)配體PD-L1在溶瘤病毒治療的(de)腫瘤內(nèi)被上調。除了PD-1外,TME中還有多種其他的(de)免疫抑制通路參與。免疫檢查點分子(zǐ),如(rú)細胞毒性T淋巴細胞抗原4(CTLA-4)、T細胞免疫球蛋白和(hé)粘蛋白結構域蛋白3(TIM-3)等經常在腫瘤浸潤淋巴細胞(TILs)上過表達,導緻活化的(de)CD8+T細胞耗竭[4]。因此,OVs聯合免疫檢查點抑制劑可(kě)以進一(yī)步增強TME中的(de)T細胞效應功能,改善抗腫瘤免疫反應,成為(wèi)一(yī)種很有前景的(de)免疫治療策略[5]。本文作者通過将一(yī)個人源化的(de)hPD-1阻斷劑基因(hPD-1)插入到親本OVH基因組中,構建了一(yī)種溶瘤性單純疱疹病毒1型(HSV-1)病毒YST-OVH。
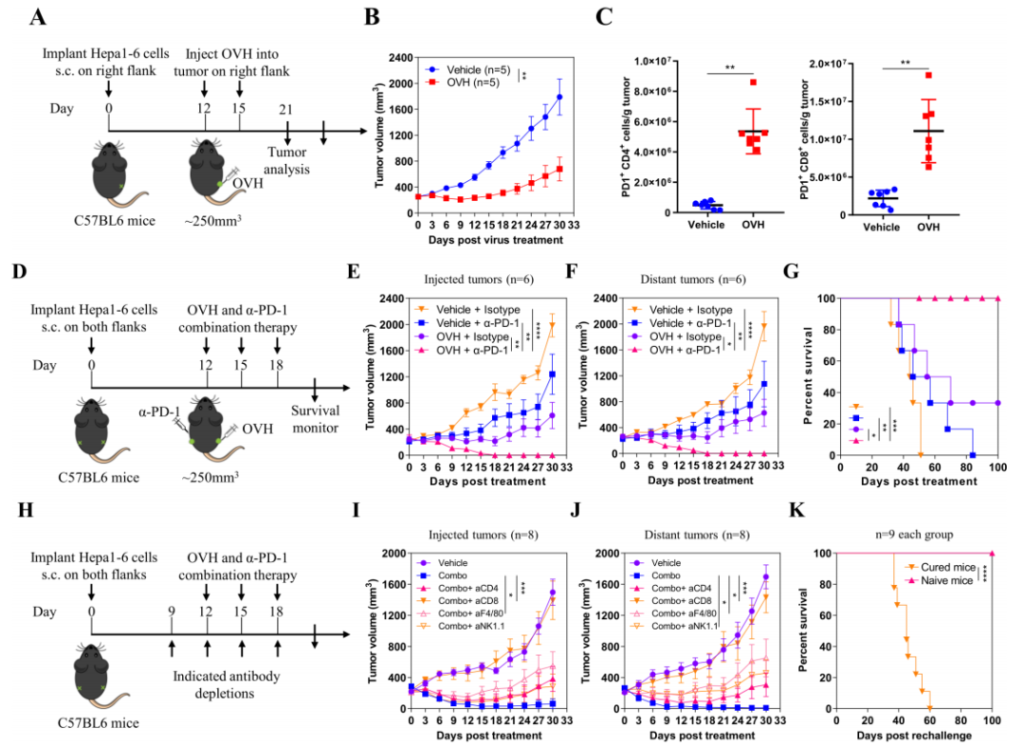
首先,作者評估了OVH的(de)抗腫瘤療效。作者使用了C57BL/6鼠,皮下注射 Hepa1-6(5×106)腫瘤細胞,腫瘤達到250mm3時瘤內(nèi)注射OVH(107 PFU)進行治療。OVH治療通過增強T細胞的(de)募集顯著抑制了腫瘤的(de)生長(cháng),但它同時增加了PD-1的(de)表達,從而阻礙了細胞毒性T細胞的(de)抗癌作用,并不能達到完全根除腫瘤的(de)效果(圖1A-C)。因此,作者結合OVH病毒治療和(hé)抗PD-1免疫治療來彌補它們各自(zì)的(de)弱點。在Hepa1-6腫瘤模型中,抗PD-1抗體(200μg)和(hé)OVH的(de)聯合使用不僅根除了病毒注射的(de)腫瘤,而且還根除了遠處腫瘤,且無複發(圖1D-G)。作者還分析了參與聯合治療的(de)關鍵免疫細胞,發現 CD8+ T 細胞在對聯合治療的(de)反應中起主要作用,并且可(kě)能需要巨噬細胞和(hé)NK細胞的(de)參與(圖1H-1K)。這些結果表明,聯合 OVH 和(hé)抗 PD-1抗體 療法可(kě)以克服免疫抑制性 TME 對免疫療法的(de)耐藥,從而增強抗癌作用。
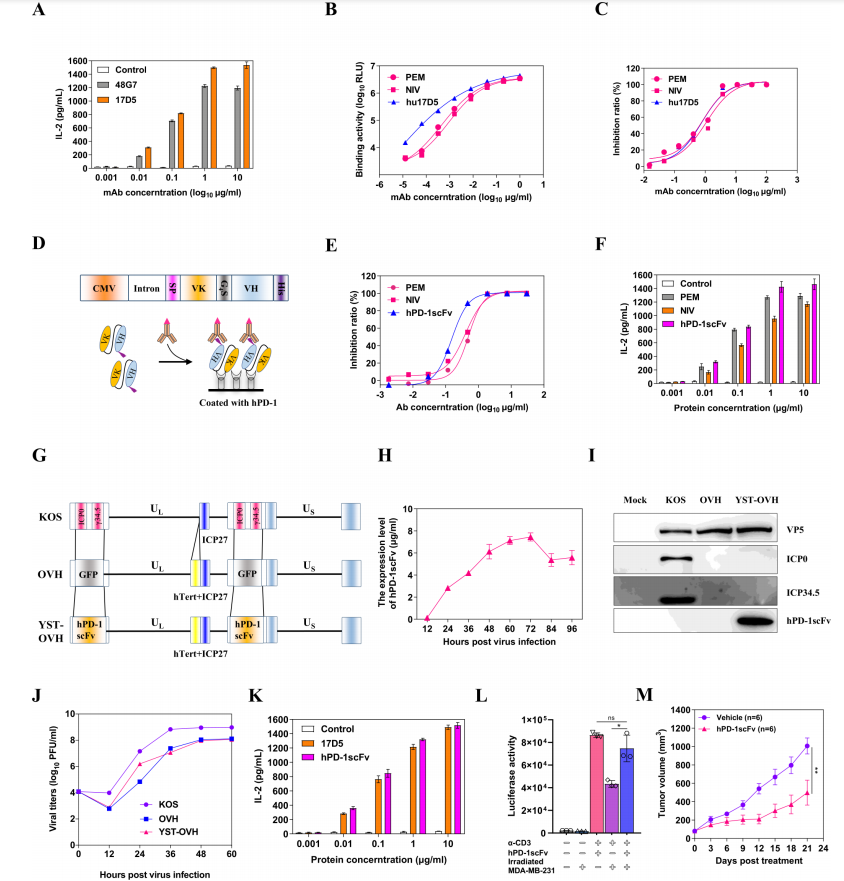
PD-1的(de)阻斷加上病毒聯合療法具有治療癌症的(de)潛力,因此,當前的(de)首要任務是構建一(yī)個能識别hPD-1的(de)人源化抗體的(de)OV,從而進一(yī)步進行臨床研究。作者通過篩選和(hé)構建,獲得了一(yī)種人源化單克隆抗體hu17D5(抗PD-1抗體),并基于hu17D5的(de)基因序列,構建了hPD-1scFv,其結合活性高(gāo)于市售的(de)抗PD-1抗體派姆單抗(PEM)和(hé)尼魯單抗(NIV)(圖2A-F)。随後,作者構建了一(yī)個新的(de)OV,序列中含有hPD-1scFV基因的(de)OV被命名為(wèi)YST-OVH(圖2G)。檢測YST-OVH感染的(de)細胞上清中hPD-1scFv蛋白的(de)表達時間依賴性上升,72h到達峰值。該病毒與親本病毒在癌細胞中的(de)複制效率相似;并能提高(gāo)對T細胞激活活性以及恢複淋巴細胞的(de)功能(圖2H-L)。值得一(yī)提的(de)是,通過構建的(de)人源化(PD-1-hu)轉基因小鼠可(kě)以很好地(dì)評估OV和(hé)hPD-1scFv誘導的(de)抗腫瘤免疫反應,因為(wèi)hPD-1scFv蛋白不能與mPD-1結合,因此在常規小鼠中沒有活性。在PD-1-HU小鼠建立的(de)Pepa-1-6腫瘤攜帶模型中驗證了hPD-1scFv有良好的(de)抗腫瘤效果(圖2M)。
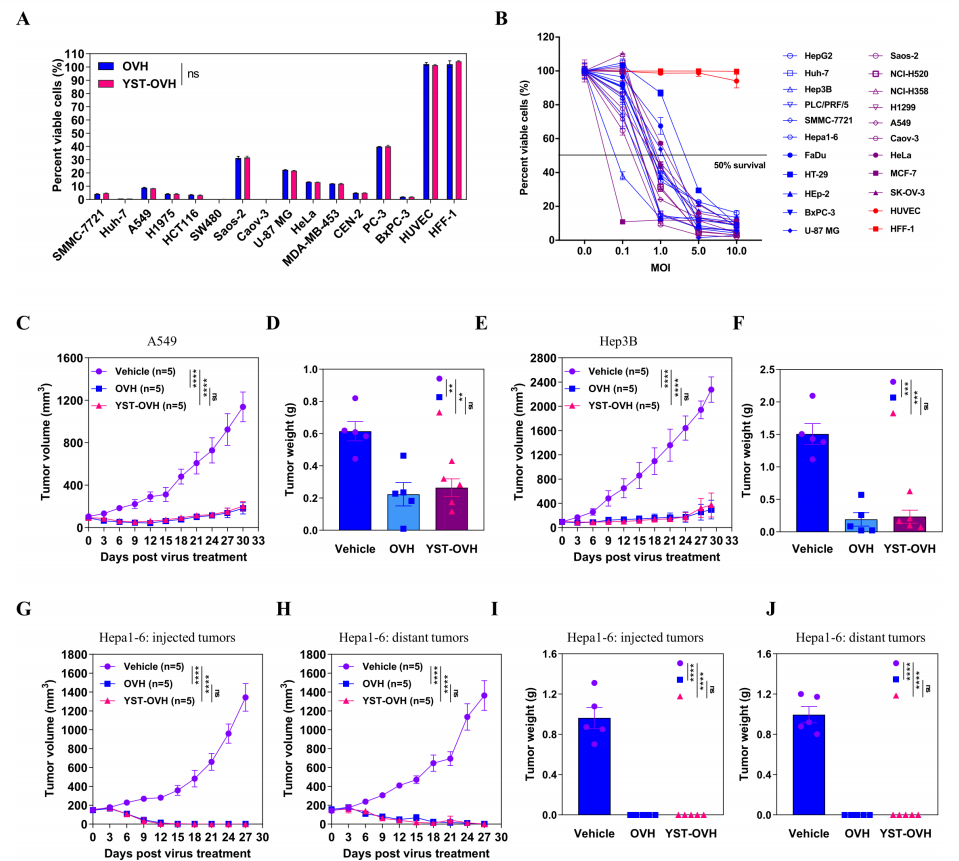
随後作者比較了YST-OVH和(hé)OVH誘導的(de)溶瘤作用,其對多種腫瘤細胞具有殺傷作用,且感染劑量與腫瘤細胞殺傷能力呈正相關(圖3A-B)。為(wèi)了進一(yī)步評估YST-OVH在體內(nèi)的(de)腫瘤細胞殺傷能力,作者在Hep3B和(hé)A549的(de)皮下移植模型小鼠中進行評估,結果觀察到類似的(de)腫瘤抑制作用(圖3C-F)。然後,作者又建立了小鼠Hepa1-6癌細胞的(de)雙側腫瘤模型。給藥後能夠使兩側腫瘤完全消退,且OVH治療小鼠和(hé)YST-OVH治療小鼠之間沒有明顯的(de)療效差異(圖3G-J)。以上這些結果表明 YST-OVH在多種類型的(de)腫瘤中複制,并且顯示出良好的(de)溶瘤作用。
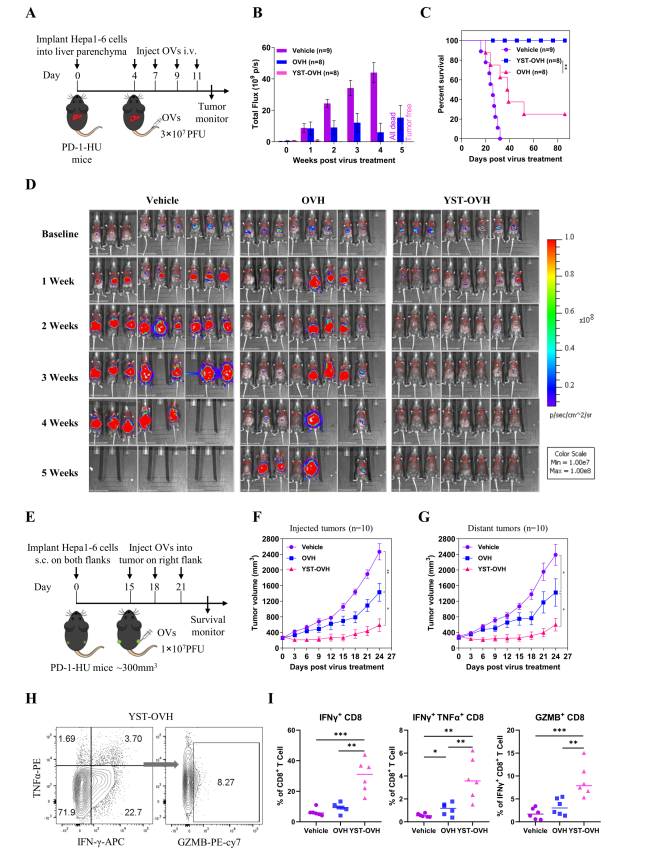
作者通過将表達螢火蟲熒光素酶基因的(de)Hepa1-6細胞肝內(nèi)注射到PD-1-HU小鼠體內(nèi),建立原位腫瘤模型,并比較靜脈注射YST-OVH與OVH的(de)效果。與其他兩組相比, YST-OVH 治療組顯著抑制了小鼠腫瘤生長(cháng)并增加了總生存時間(圖 4A-D)。随後作者通過皮下注射Hepa1-6 細胞建立了PD-1-HU 小鼠的(de)雙側腫瘤模型,以比較 YST-OVH 與 OVH在瘤內(nèi)注射的(de)藥效。結果發現,YST-OVH治療組比OVH治療組的(de)小鼠腫瘤消退作用更強,且對遠側的(de)腫瘤也有更好的(de)效果。流式分析結果顯示,注射YST-OVH顯著誘導IFN-γ+CD8+T細胞、IFN-γ+T-NF-α+CD8+ T細胞和(hé)GZMB+CD8+ T細胞的(de)活化。以上結果表明 YST-OVH 可(kě)以通過激活腫瘤浸潤性 CD8+ T 細胞來增強抗腫瘤功效(圖4H-I)。
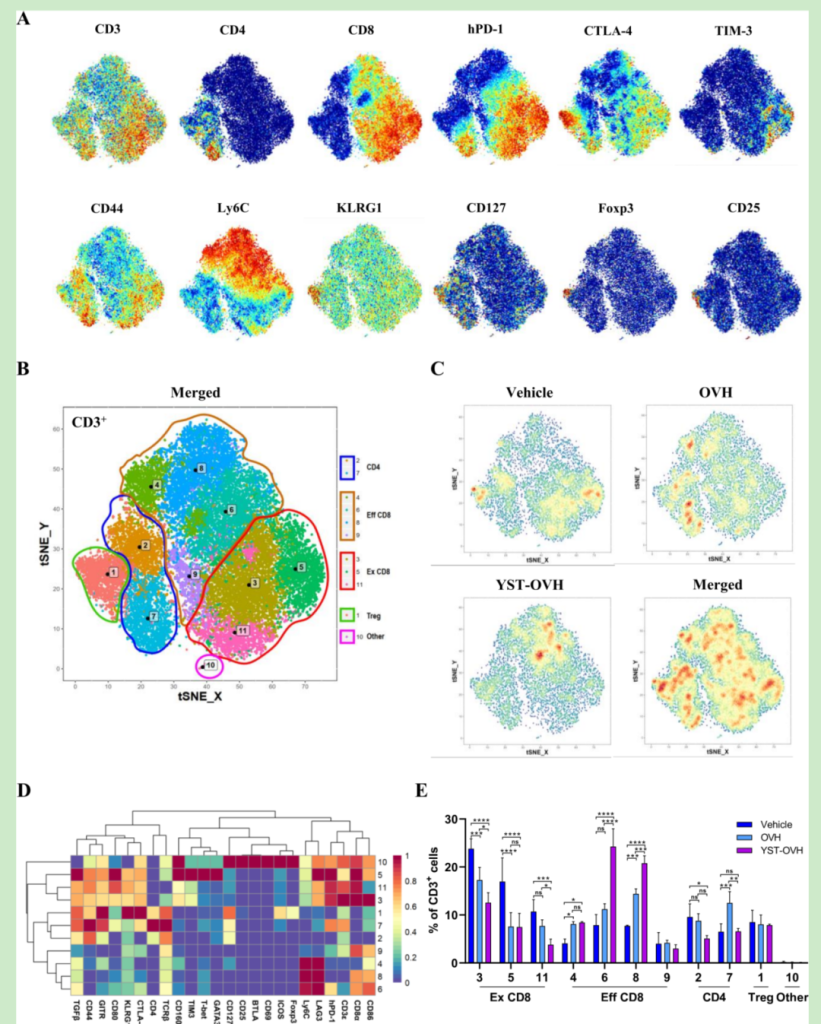
接下來,作者通過使用CyTOF分析 TME中的(de)精确動力學(xué)來确定YST-OVH在抗腫瘤中發揮的(de)免疫相關的(de)作用。我們重點分析了T細胞亞群,當單個Marker在t-SNE圖中突出顯示時,指示T細胞的(de)活化、分化以及耗竭的(de)關鍵标記定位在同一(yī)位置(圖5A)。PhenoGraphy對T細胞亞群的(de)再分析,确定了10個主要的(de)T細胞細分亞群:CD8+T細胞(T3、T4、T5、T6、T8、T9和(hé)T11)、CD4+T細胞(T2和(hé)T7)、Treg細胞(T1)和(hé)其他CD3+細胞(T10)(圖5B)。
對這些T細胞簇的(de)分析顯示, OVH或YST-OVH治療後,TME中的(de)T細胞群發生顯著變化(圖5C)。在熱圖中顯示了每個T細胞簇上24個不同标記的(de)表達譜(圖5D)。圖5E顯示了每個T細胞簇在整個腫瘤浸潤T細胞群中的(de)比例。值得注意的(de)是,OVH治療和(hé)YST-OVH治療都導緻了T細胞群體的(de)顯著變化,其中YST-OVH顯著增加了殺傷性T細胞中T6和(hé)T8比例,而耗竭性T細胞中T3,T5以及T11在對照組中普遍存在,OVH治療後顯著降低(dī),而YST-OVH則降低(dī)得更為(wèi)明顯,特别是T3和(hé)T11。更為(wèi)重要的(de)是,YST-OVH組中殺傷性T細胞高(gāo)表達記憶性CD8+T細胞的(de)Marker基因Ly6C,後來實驗也證明瘤內(nèi)注射溶瘤病毒能夠誘導産生腫瘤特異性以及病毒特異性的(de)記憶T細胞。
有趣的(de)是YST-OVH能夠誘導産生很強的(de)腫瘤特異性記憶T細胞,而産生很弱的(de)病毒記憶性T細胞,說明YST-OVH能夠比OVH或對照組更早地(dì)影響CD8+T細胞,而且可(kě)能是通過重編程效應CD8+T細胞為(wèi)記憶性T細胞,從而改變整個瘤內(nèi)TME環境此外,在所有耗竭性CD8細胞群中,抑制性受體基因CTLA-4和(hé)TIM3都有高(gāo)表達,然而OVH或YST-OVH對T7細胞群都沒有明顯的(de)作用,說明也許通過适當的(de)免疫檢查點阻斷(如(rú)抗CTLA-4或抗TIM-3治療)來逆轉T細胞衰竭和(hé)阻斷活化的(de)Treg細胞,可(kě)能能夠進一(yī)步促進YST-OVH治療的(de)抗腫瘤作用。
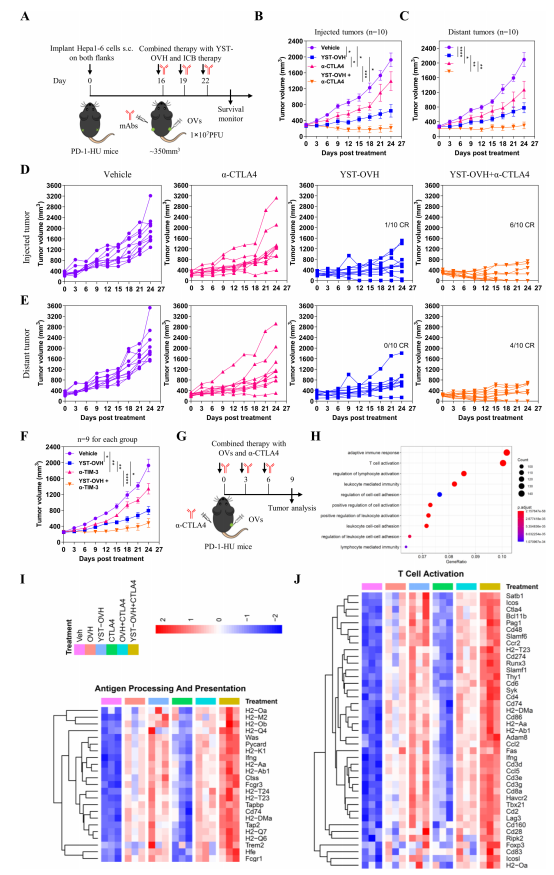
為(wèi)了探讨聯合抗CTLA-4是否能增強YST-OVH的(de)抗腫瘤療效,作者在此通過動物實驗進行驗證。如(rú)圖6B、C所示,YST-OVH,抗CTLA-4單藥治療均顯著抑制兩側腫瘤的(de)生長(cháng)。此外,YST-OVH和(hé)抗CTLA-4聯合治療進一(yī)步減少了兩側腫瘤的(de)體積,4隻小鼠的(de)注射側腫瘤獲得了完全緩解,6隻小鼠的(de)遠側腫瘤完全緩解(圖6D-E)。随後比較了YST-OVH和(hé)抗TIM-3的(de)抗腫瘤作用,均顯著抑制腫瘤的(de)生長(cháng)(圖5F)。這些結果表明,抗CTLA-4或抗TIM-3聯合治療進一(yī)步提高(gāo)了YST-OVH的(de)抗腫瘤療效。通過獲取治療小鼠的(de)腫瘤,對RNA測序數據的(de)分析顯示,一(yī)些免疫相關的(de)信号通路,在共同治療的(de)腫瘤中顯著富集。這些結果表明,YST-OVH和(hé)抗CTLA-4聯合應用可(kě)通過提高(gāo)腫瘤的(de)免疫原性,進一(yī)步提高(gāo)抗腫瘤療效。
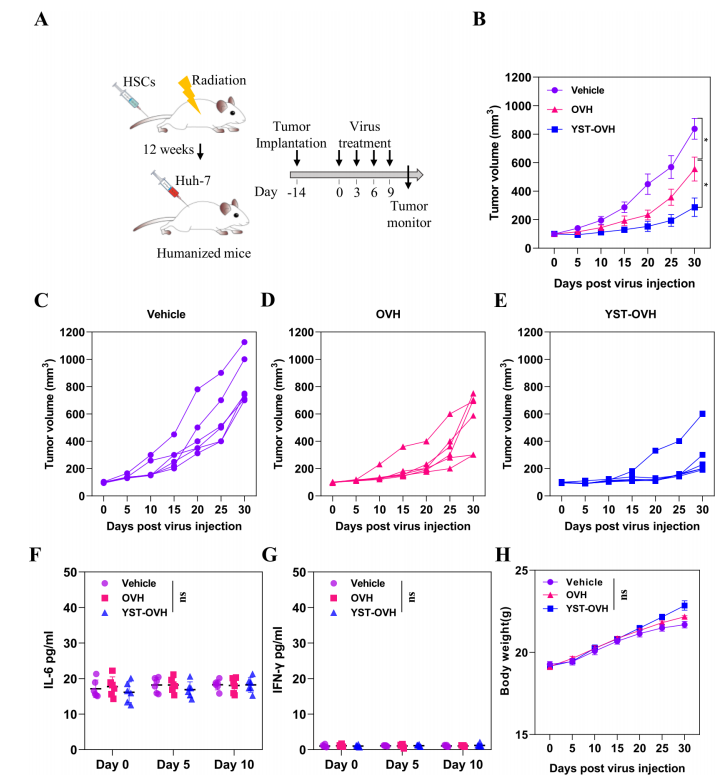
圖 7 YST-OVH 治療可(kě)抑制人源化小鼠的(de)腫瘤進展,而不會誘導強烈的(de)炎症反應最後,作者使用人源化小鼠模型測試了YST-OVH的(de)有效性。将Huh-7人肝癌細胞皮下植入NSG小鼠中,YST-OVH顯著抑制腫瘤的(de)生長(cháng),且作用優于OVH(圖7B-E)。此外,并沒有觀察到細胞因子(zǐ)升高(gāo)或體重的(de)顯著變化(圖7F-H)。總的(de)來說,這些結果表明,YST-OVH顯著增強了抗腫瘤療效,并可(kě)能在人源化小鼠模型中具有良好的(de)耐受性。通過工程化的(de)YST-OVH 局部遞送 PD-1 抑制劑是一(yī)種高(gāo)效且安全的(de)癌症免疫治療策略。 YST-OVH 還與 CTLA-4 或 TIM-3 阻斷劑協同作用以增強對癌症的(de)免疫反應。 這些數據為(wèi)進一(yī)步臨床評估這種新的(de)治療方法提供了強有力的(de)依據。
參考文獻:
[1] Harrington K, Freeman DJ, Kelly B, et al. Optimizing oncolytic virotherapy in cancer treatment. Nat Rev Drug Discov 2019;18:689–706.
[2] Chen DS, Mellman I. Elements of cancer immunity and the cancer immune set point. Nature2017;541:321–30.
[3] Sharma P, Allison JP. The future of immune checkpoint therapy. Science 2015;348:56–61.
[4] Binnewies M, Roberts EW, Kersten K, et al. Understanding the tumor immune microenvironment (TIME) for effective therapy. Nat Med 2018;24:541–50.
[5] Bommareddy PK, Shettigar M, Kaufman HL. Integrating oncolytic viruses in combination cancer immunotherapy. Nat Rev Immunol 2018;18:498–513.
